発熱反応の身近な例についてご説明します。
発熱反応とは?
「発熱反応」とは、化学反応が起こる際に周囲に熱を放出する現象のことを言います。
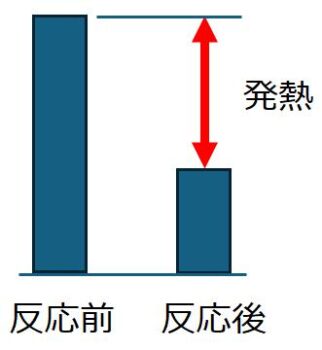
発熱により物質がもつエネルギーは、反応前よりも反応後が低くなります。
学術的には、発熱反応とは「物質が化学変化を起こすことで熱を発する反応」のことを指しますが、日常的にはそれに加えて、物質の状態変化(たとえば水蒸気が水になるなど)によって熱が感じられる現象も「発熱」として捉えられることがあります。
この記事では、化学反応としての発熱反応だけでなく、一般的に「暖かくなる」「熱が出る」と感じる現象も含めて、身近な例をたくさん紹介していきます。
発熱反応の身近な例
燃焼反応
燃焼反応とは、物質が酸素などの酸化剤と反応して、光や熱を出す化学反応のことです。
特に、燃えるように急激に熱と光を発する反応を「燃焼」と呼びます。
一番身近な酸化剤は「酸素(O₂)」です。酸素と反応しやすい物質、つまり「可燃物(燃えやすいもの)」には、木材、紙、ガソリン、アルコール、天然ガス(メタン)などがあります。
燃焼には「燃えるもの(可燃物)」「酸素(酸化剤)」「十分な温度(発火点以上)」の3つがそろうことが必要です。これを「燃焼の三要素」と言います。
燃焼の例



ろうそくはパラフィンという炭化水素でできていて、火をつけると空気中の酸素と反応し、二酸化炭素と水を出しながら熱と光を放ちます。これは代表的な燃焼反応です。
焚き火やストーブで木材や紙が燃えるのも、酸素との反応(燃焼反応)です。炭素や水素を含む有機物が酸化され、二酸化炭素、水、熱が生じます。
理科の実験で使うアルコールランプも、アルコールが酸素と反応して熱と光を発しています。燃料に使われるエタノール(C₂H₅OH)も酸化されて二酸化炭素と水になります。
下表に代表的な燃焼を整理しました。表の下の方に行くほど燃料に含まれる炭素の量が減って、二酸化炭素の排出量が少なくなります。
| 状態 | 燃える物の例 | 成分 | 主な生成物 | 簡単な反応式の例 | 備考 |
|---|---|---|---|---|---|
| 固体 | 木炭、炭 | 炭素(C) | CO₂ | C + O₂ → CO₂ | ゆっくり燃える |
| 固体→液体→気体 | パラフィン(ロウソク) | 炭化水素(CₙH₂ₙ₊₂) | CO₂ + H₂O | C₁₂H₂₆ + O₂ → CO₂ + H₂O | 熱で気化して燃える |
| 液体→気体 | 灯油、ガソリン | 炭化水素 | CO₂ + H₂O | C₈H₁₈ + O₂ → CO₂ + H₂O | 揮発してから燃える |
| 気体 | メタン(CH₄) | 炭化水素 | CO₂ + H₂O | CH₄ + 2O₂ → CO₂ + 2H₂O | 家庭用ガスなど |
| 気体 | 水素(H₂) | 水素 | H₂O(水) | 2H₂ + O₂ → 2H₂O | クリーンな燃焼 |
マグネシウムの燃焼

日常で目にすることは有りませんが理科ではおなじみの実験です。マグネシウムが空気中の酸素と結合して、酸化マグネシウム(MgO)になる反応です。このときに熱を発生します。
火薬や花火の燃焼(酸素を使わない例)

火薬や花火は、酸素を使わなくても燃焼します。
これは、内部に「酸化剤(例えば硝酸カリウムなど)」を含んでいるからです。
酸化剤が燃料に酸素を供給することで、空気中の酸素がなくても反応が進みます。これも発熱反応の一種です。
酸化反応
酸化反応とは、ある物質が酸素やその他の酸化剤と結びつく化学反応のことです。燃焼反応も酸化反応の一種ですが、ここで紹介するのは炎や光をともなわず、ゆっくりとしたスピードで進む酸化反応です。
燃焼反応は急激に進行し、大量の熱と光を出しますが、酸化反応は穏やかに進行しながら、目立たない形で熱を生み出します。そのため見た目にはわかりにくいのですが、エネルギーの流れという観点から見ると、これも確かに「発熱反応」にあたります。
鉄がさびる反応

鉄が水や空気に触れて錆びていく過程も酸化反応です。このときにも微量の熱が発生しますが、反応が非常にゆっくりなので体感することはありません。
マグネシウムでは激しく燃焼しましたが、鉄では非常にゆっくりで、反応性が大きく影響します。酸素と化合する同じ反応でも、鉄では酸化反応と呼びます。
使い捨てカイロ

冬に手を温めるために使う「使い捨てカイロ」には、鉄の粉が入っています。
カイロの袋を開けると中の空気と触れ、鉄が酸素とゆっくり反応して酸化鉄になる、この酸化の過程で熱が発生し、じんわりと温かくなるのです。
燃えたり炎が出たりしない「見えない燃焼」のようなものです。
鉄が錆びる現象と同じ反応ですが、鉄粉にすることで表面積を増やし、さらに活性炭、保水材、塩類などによって反応速度を速めています。
ただし、長い時間をかけて進む反応であっても、酸素と結びつくことでエネルギーが放出されるという点では発熱反応です。
燃料電池
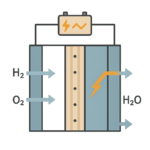
燃料電池は、水素を燃料にして発電し、ゆっくりと酸素と反応させることで発電する装置です。電気エネルギーに変換できない分が熱エネルギーとして発生します。酸化による発熱反応を機械的に制御しながら行う装置とも言えます。
人間の呼吸
私たちの体の中では、食べたもの(ご飯、パン、脂肪など)を分解し、酸素と反応させてエネルギーを生み出しています。
これを「細胞呼吸」といい、グルコース(ブドウ糖)と酸素が反応して二酸化炭素と水、そして熱とエネルギー(ATP)を生み出します。この熱が体温として現れ、私たちの体を温かく保っているのです。
塩素やフッ素との反応(酸素以外の酸化剤)

酸素以外にも、塩素(Cl₂)やフッ素(F₂)といった非常に反応性の高い物質と結びついて熱を出す反応もあります。
たとえば、ナトリウムと塩素を反応させると、激しい発熱と共に塩(塩化ナトリウム)ができます。このような反応も「酸化反応=発熱反応」の一例です。
このように、②の酸化反応の例は、①の燃焼反応のように急激に燃え上がったりするわけではありませんが、時間をかけて穏やかに進む中でも、確実に熱を生み出す、身近で大切な発熱反応なのです。
水和反応
水和反応とは、水が化学物質と反応して新しい物質を作るときに起こる反応です。このとき、水が取り込まれることで、化学結合が変化し、エネルギーが放出されます。つまり、熱が出る「発熱反応」なのです。水和反応はセメントや乾燥剤など、私たちの身の回りでもよく使われており、見た目には大きな変化がない場合でも、触ると熱くなっていることでその反応がわかります。
石灰乾燥剤の発熱

食品の袋などに入っている「乾燥剤」には、酸化カルシウム(生石灰)が入っていることがあります。
これが水と反応すると水酸化カルシウムになり、熱を大量に出します。
手で触れるとやけどするほど高温になることもあるため、注意が必要です。
セメントが固まるとき

セメントを水で練ると、粉の中に含まれる物質が水和反応を起こして硬化していきます。
この反応でも熱が出るため、大量のセメントを使う工事では、内部の温度が非常に高くなることがあります。これを「水和熱」と言います。
駅弁などの加熱剤

加熱式の駅弁や登山食などに入っている発熱パックは、酸化カルシウムと水が反応することで熱を発生させ、ご飯やおかずを温めてくれます。水和反応の熱を利用した便利な仕組みです。
このように水和反応は、化学変化の一種でありながら、炎や煙が出ることなく静かに、そして確実に熱を発する反応として活用されています。
酸と金属の反応
金属が酸と反応すると、水素ガスを発生させながら金属塩を作り出す反応が起こります。このときにも熱が発生します。反応の強さは金属の種類や酸の濃度によって異なりますが、比較的簡単な実験で確認することができます。
鉄やアルミと塩酸の反応

理科の授業でもよく行われる実験で、鉄やアルミニウムの金属片を塩酸に入れると、しゅわしゅわと泡が出てきます。
これは水素ガスが発生している証拠であり、同時に容器の外側がほんのり温かくなることもあります。これは、化学反応によって熱が出ている証拠です。
電池の中の反応にも応用
乾電池やボタン電池の中でも、金属と酸や電解質が反応して電気を作り出すときに、わずかに熱が発生します。
このように、酸と金属の反応は比較的わかりやすく、身近な教材としても優れており、発熱反応のしくみを理解するのに適した例です。
生物的・発酵による発熱
微生物が生き物の一部を分解していくときに起こる化学反応を「発酵」といいます。
この発酵反応の中にも、エネルギーが放出され、熱が出るものがあります。私たちの体や、自然の中でもよく見られる反応です。
生ごみや堆肥の発酵

家庭や農業で出る生ごみや落ち葉などを堆肥にするために積んでおくと、時間とともに中から湯気が出たり、手で触ると温かく感じたりします。
これは、微生物が有機物を分解して発酵し、その過程で熱を発しているからです。
発酵食品の製造過程

味噌や納豆、ヨーグルト、パン、お酒などを作るときにも、菌が材料を分解しながら発酵して熱を出す場合があります。
発熱反応をうまくコントロールしないと美味しくなりません。特に大規模な発酵タンクでは、温度管理が重要になります。
人間の体の中でも発熱

私たちの体内でも、腸内細菌などが発酵に近い働きをしており、わずかではありますが熱が発生しています。食べ物の消化・吸収に関わるこの反応も、生物が関与する発熱反応のひとつです。
このように、微生物の働きによって起きる発熱反応は、自然界の循環や私たちの生活と深く関わっています。
結晶化による発熱
結晶化とは、液体や気体の中にある粒子が規則正しい並び方(結晶構造)になって固まる現象です。
このとき、粒子同士が結びつくことでエネルギーが放出され、周囲に熱を与えることがあります。
化学カイロ(再利用可能タイプ)

「再利用できるカイロ」として、酢酸ナトリウムなどが使われているものがあります。
この物質が液体の状態で容器に入っており、金属片を押して刺激を与えることで結晶化が始まり、熱が出て温かくなります。
これは「過冷却」という特別な状態から、一気に結晶化するときの凝固熱により起こる発熱です。
身近な結晶化の応用

塩が水に溶けた状態からゆっくりと冷やしていくと結晶ができるように、食塩や砂糖の結晶化でもわずかに熱が出ます。
日常では感じにくいですが、物質の構造が変わるときにはエネルギーの出入りがあることを示しています。
このように、結晶化という一見静かな現象の中にも、実は熱の出入りがあり、発熱反応として捉えられることがあります。
相変化による発熱
相変化とは、物質が「固体」「液体」「気体」といった状態を変えることです。たとえば、水蒸気が水に変わる(凝縮)や、水が氷になる(凝固)などが相変化にあたります。
こうした変化の過程では、温度変化はしませんが、潜熱と呼ばれる熱の出入りがあります。
水蒸気が水に戻るとき(凝縮)

空気中の水蒸気が冷えて水滴になるとき、実は周囲に熱を出しています。たとえば、寒い日に窓に結露ができると、窓のそばが少し暖かく感じることがあります。
これは水蒸気が水になることで熱が放出されているからです。
水が凍るとき(凝固)

水が氷になるときも、分子が規則正しく並んで固まることでエネルギーが放出され、周囲に熱が伝わります。
氷ができるときに熱が出るというのは不思議に思えるかもしれませんが、実際には周囲を暖めているわけです。
羽毛布団、ダウンジャケット

羽毛は、体からの熱を微細な構造で保持して断熱するだけでなく、中の湿気(水蒸気)がわずかに水滴になるときに放出する熱(凝縮熱)による発熱体としての働きもあります。
これは毛管凝縮という、狭い隙間に入り込んだ水蒸気が液化しやすくなる性質によるものです。
このように、相変化による発熱は、自然の中で日々起こっている現象です。
その他の発熱
ご飯が炊けるときの熱の変化

ご飯を炊くと、お米の中のデンプンが水と熱によって「糊化(こか)」という変化を起こします。このとき、デンプンの構造が変わることで吸収した水が安定した形になり、微量ながら熱が出ることがあります。
ただし、炊飯器の中では加熱されているため、実際にはこの熱は目立ちません。
多くの現象は発熱反応
発熱反応というのは本来、化学反応のことですが、発熱する現象をすべて発熱反応と捉えるのであれば、多くの現象(何らかの変化)は発熱反応だとも言えます。
例えば、物を床に落とすと、位置エネルギーが運動エネルギーに変わり、最終的には熱エネルギーとして散逸します。落下の衝撃が加わった部分の温度は僅かながら上がっているはずです。
熱は、最終的なエネルギーの行きつく先なのです。
まとめ
さまざまな発熱反応の例を紹介しました。
それぞれの反応が起きる仕組みや、私たちの生活でどのように役立っているのかを知ることで、科学がより身近に感じられるようになるはずです。
発熱反応は、目には見えないけれど私たちの生活の中で常に起こっているといえます。